Negli ultimi tre anni sono state somministrate oltre 13,5 miliardi di dosi di vaccini anti Covid19 a livello globale. A novembre 2023 almeno il 70,5% della popolazione mondiale aveva ricevuto almeno una dose di vaccino: si tratta di uno scenario senza precedenti, che ha consentito un’importante ricerca aggiuntiva sulla sicurezza dei vaccini che permette di rilevare effetti avversi anche molto rari. Recentemente, il Global Vaccine Data Network (GVDN) ha pubblicato il più grande studio mai realizzato con l’obiettivo di facilitare questo tipo di valutazioni e, quindi, di intervenire nella somministrazione dei vaccini sulla base dei risultati di volta in volta aggiornati.
L’indagine si è concentrata su tredici condizioni mediche che il gruppo ha considerato “eventi avversi di particolare interesse” come trombosi, pericardite, miocardite e altre condizioni, riscontrati tra oltre 99 milioni di individui vaccinati in otto Paesi e, attraverso l’uso di dati aggregati, ha identificato le patologie che si sono verificate più volte. L’indagine ha evidenziato che il rischio fino a quarantadue giorni dopo la vaccinazione era generalmente simile al rischio di fondo, fatta eccezione per alcuni eventi rari che hanno interessato in particolare i vaccini che utilizzano una versione modificata dell’adenovirus dello scimpanzé, non più in grado di replicarsi, come vettore DNA per fornire le istruzioni per sintetizzare nel nucleo delle cellule umane la proteina spike di SARS-CoV-2.
La valutazione degli eventi avversi consente di intervenire per monitorare i segnali di sicurezza
Nel 2020, in previsione del lancio globale di vaccini contro il Covid-19, l’iniziativa Safety Platform for Emergency Vaccines (SPEAC) ha formulato un elenco di potenziali eventi avversi di particolare interesse (AESI) dovuti al vaccino in base a precedenti esperienze maturate sulla conoscenza della malattia , dati rilevati dalle piattaforme vaccinali o modelli animali che utilizzano i vaccini candidati.
Per la valutazione dell’AISI si è scelto il confronto dei tassi di AESI osservati dopo l’introduzione di un programma di vaccinazione con i tassi attesi basati su periodi storici precedenti al lancio del vaccino.
Tali confronti, di rapida esecuzione, consentono l’individuazione precoce di potenziali segnali di sicurezza (effetti avversi) dei vaccini e alle agenzie di regolamentazione e di sanità pubblica una più rapida valutazione di un segnale di sicurezza emergente. Ad esempio, è stata fondamentale per identificare la trombosi con sindrome da trombocitopenia (TTS) come segnale di sicurezza, spingendo alla sospensione dell’uso del vaccino di AstraZeneca l’11 marzo 2021 in Danimarca e Norvegia e alla limitazione del suo impiego in altri Paesi.
I dati di quasi un miliardo di vaccinati permettono di conoscere effetti avversi anche molto rari
Queste valutazioni sono preziose non solo all’inizio della distribuzione dei vaccini su larga scala, ma anche man mano che il programma di vaccinazione matura, soprattutto se possono essere condotte in un contesto multinazionale.
È quanto si è proposto lo studio di coorte globale realizzato dal progetto Global COVID Vaccine Safety (GCoVS), istituito nel 2021 nell’ambito della rete multinazionale GVDN che ha realizzato uno studio teso a valutare il rischio di eventi avversi di particolare interesse a seguito della vaccinazione Covid-19 utilizzando i dati di più siti all’interno della rete.
Utilizzando un protocollo comune, lo studio ha confrontato i tassi osservati con quelli attesi di tredici AESI selezionati in base agli esiti neurologici, ematologici e cardiaci.
In generale, i periodi di studio sono andati da dicembre 2020 ad agosto 2023 in dieci 10 siti di otto Paesi di Europa, Nord America, Sud America e Oceania e lo studio si è concentrato sui tre vaccini maggiormente somministrati (Pfizer/Biontech, Moderna e Astrazeneca).
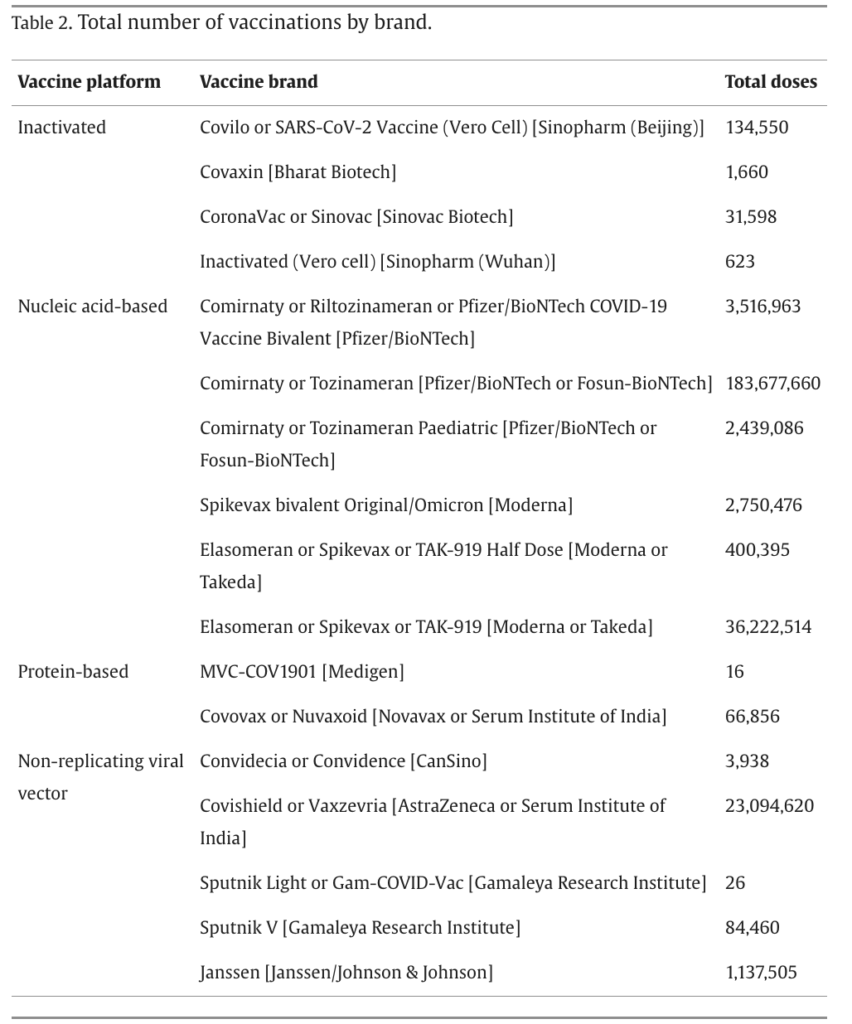
In particolare, la popolazione totale vaccinata in tutti i siti comprendeva 99.068.901 individui, la maggior parte dei quali apparteneva ai gruppi di età 20-39 e 40-59 anni.
Nei periodi di studio sono state somministrate complessivamente 183.559.462 dosi di Pfizer/BionTech, 36.178.442 dosi di Moderna e 23.093.399 dosi di Astrazeneca.
Alcuni esempi di effetti avversi rari emersi con l’indagine
Lo studio del Global COVID Vaccine Safety ha inclusi gli eventi avversi di particolare interesse che si sono verificati fino a quarantadue giorni dopo la vaccinazione con vaccini a mRNA (BNT162b2 e mRNA-1273) e a vettore adenovirale (ChAdOx1). L’indagine ha evidenziato che il rischio fino a quarantadue giorni dopo la vaccinazione di eventi avversi non era molto dissimile al rischio di fondo per la maggior parte degli esiti; tuttavia, sono stati identificati alcuni potenziali segnali di sicurezza significativi di un incremento degli eventi avversi ancorché rari.
Ad esempio, sono stati osservati potenziali segnali di sicurezza di rischi neurologici per GBS (Guillain-Barré) e CVST (trombosi del seno venoso cerebrale) dopo la prima dose di Astrazeneca sulla base di oltre 12 milioni di dosi somministrate, con un aumento statisticamente significativo nei casi di GBS dopo una prima dose.
Tali risultati confermano quanto evidenziato da precedenti studi sui vaccini basati su vettori simili, mentre la maggior parte degli studi sui vaccini mRNA, come Pfizer/Biontech e Astrazeneca, non hanno osservato aumenti di GBS.
Sebbene rara, questa associazione è stata riconosciuta dall’Oms, dall’Agenzia europea per i medicinali (European Medicines Agency, EMA) e dalla Therapeutic Goods Administration (TGA) dell’Australia, con il risultato che la GBS è stata elencata come effetto collaterale raro in seguito all’esposizione a quel particolare tipo di vaccino.
Per quanto concerne l’aumento del rischio di CVST (trombosi del seno venoso cerebrale) in seguito alla vaccinazione con Astrazeneca, entro quarantadue giorni dopo la prima dose, a fronte dei ventuno eventi attesi ne sono stati osservati sessantanove.
Si tratta, peraltro, di dati già evidenziati da altri studi. Alla fine, questo segnale di sicurezza raro ma preoccupante ha portato al ritiro del vaccino dai programmi di vaccinazione contro il Covid-19 o all’implementazione di restrizioni basate sull’età in più Paesi.
Inoltre, lo scorso maggio la ditta produttrice , AstraZeneca ha annunciato l’avvio di una procedura di ritiro globale del suo vaccino anti Covid-19, comunicando anche l’intenzione di revocare le autorizzazioni per la commercializzazione del Vaxzevria in Europa, motivando tale decisione con la “disponibilità eccessiva di versioni aggiornate del vaccino.” La scelta di fatto segue l’ammissione, avvenuta alla fine dello scorso aprile durante un procedimento legale a Londra, della possibilità di trombosi come raro effetto collaterale del vaccino anti Covid prodotto dall’azienda anglo-svedese.

