L’ultimo giorno di febbraio ricorre la Giornata mondiale delle malattie rare (Rare Disease Day), movimento globale sulle malattie rare che lavora per l’equità nelle opportunità sociali, nell’assistenza sanitaria e nell’accesso alla diagnosi e alle terapie per le persone che vivono con una malattia rara.
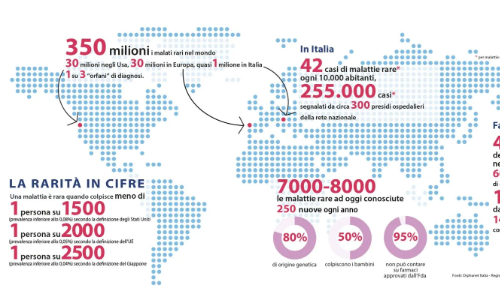
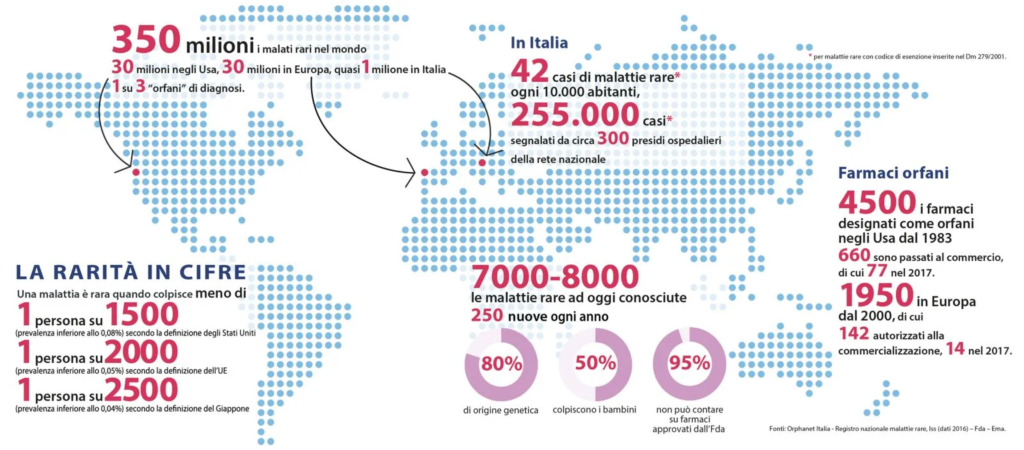
Al 2018, le persone con malattie rare nel mondo sono più di 300 milioni, con oltre 250 mila casi di malattie rare riconosciute dal Sistema sanitario nazionale segnalati in Italia. Delle oltre seimila malattie rare identificate, circa quattro su cinque sono di origine genetica.
A causa del numero relativamente esiguo di malati, una grande difficoltà sta nella ricerca e produzione di terapie. Sviluppare e produrre farmaci per una malattia rara (definiti “farmaci orfani”) può infatti costare molto, trattandosi spesso di terapie avanzate, genetiche e cellulari. A fronte di un costo elevato e di pochissimi pazienti target, le industrie farmaceutiche non hanno un particolare interesse economico nel trattare questo tipo di malattie, dato che difficilmente potrebbero ricavare un buon profitto.
Il nostro Paese fra i migliori in Europa
L’ultimo rapporto annuale dell’Osservatorio farmaci orfani posiziona l’Italia al secondo posto tra i Paesi europei con la più alta disponibilità di farmaci orfani (50, corrispondenti all’82% del totale dei prodotti approvati dall’European Medicines Agency – EMA- nel periodo considerato), emergendo come uno dei Paesi che meglio garantiscono l’accesso ai farmaci orfani innovativi.
Proprio a causa del disinteresse delle industrie farmaceutiche per i farmaci orfani, il compito di produrre e distribuire questi farmaci potrebbe passare al terzo settore.
Il primo caso di no-profit a produrre e distribuire un farmaco
È quanto successo a Strimvelis, una terapia genica approvata in Europa per l’immunodeficienza severa combinata da deficit di adenosina-deaminasi (ADA-SCID), conosciuta anche come sindrome dei bambini bolla.
Nel 2022, l’azienda farmaceutica anglo-statunitense Orchard Therapeutics ha annunciato di voler disinvestire nel campo delle immunodeficienze primitive, terminando il suo lavoro su alcuni trattamenti tra cui Strimvelis. L’anno dopo, a seguito del parere positivo dell’EMA, la Commissione europea ha approvato il trasferimento dell’autorizzazione all’immissione in commercio della terapia in Europa alla Fondazione Telethon. È la prima volta al mondo che un’organizzazione no-profit si assume la responsabilità di produrre e distribuire un farmaco per una malattia rara.
Si stima che in Unione europea ogni anno nascano tra i 6 e gli 11 bambini con l’ADA-SCID. Questa malattia genetica molto rara e potenzialmente mortale è causata da un gene difettoso che blocca la produzione di un enzima (ADA) necessario per la produzione e la maturazione dei linfociti. Chi nasce con questa condizione non ha un sistema immunitario sano ed è costretto a vivere in un ambiente sterile e isolato, come in una “bolla”.
Tra le terapie possibili, la prima scelta è il trapianto di cellule staminali ematopoietiche, che danno origine alle cellule del sangue, da donatore familiare compatibile. Quando non è possibile il trapianto, entra in gioco la terapia genica, da somministrare una sola volta nell’arco della vita. Strimvelis “viene preparato a partire dalle cellule staminali ematopoietiche prelevate dal paziente stesso, messe a contatto con un vettore di origine virale contenente una versione corretta del gene difettoso nei pazienti (ADA) che è in grado di ripristinare la produzione della proteina mancante a causa del difetto genetico” – spiega Telethon – “Reinfuse nel sangue, le cellule così corrette sono in grado di differenziarsi anche negli elementi precedentemente mancanti (linfociti), e di difendere così l’organismo dalle infezioni.”
La storia di questa terapia genica è iniziata con Telethon e ora torna di nuovo in mano alla stessa Fondazione. “Nel 1995, grazie alla ricerca dell’Istituto San Raffaele-Telethon per la terapia genica (SR-TIGET) viene sviluppato Strimvelis, arrivando nel 2000 a trattare la prima paziente – spiega ad Agenda17 Stefano Benvenuti, responsabile relazioni istituzionali della Fondazione Telethon –. A causa della mancanza di expertise specifica all’interno della Fondazione per la produzione di terapie, viene stipulato un accordo con l’azienda farmaceutica GlaxoSmithKline (GSK), ottenendo nel 2016 l’approvazione dell’EMA”, prima volta che una terapia genica curativa per i bambini riceve l’approvazione regolatoria.
Successivamente, GSK passa Strimvelis a Orchard Therapeutics.
“Il disinvestimento di Orchard Therapeutics nel 2022 avrebbe comportato l’uscita di Strimvelis dal mercato e per produrlo nuovamente sarebbe servita una nuova approvazione da parte di EMA – continua Benvenuti –. Il rischio del ritiro era inaccettabile per Telethon, che ha dunque deciso di farsene carico. Questa operazione ha necessitato di importanti modifiche organizzative interne, tra cui la modifica dello stesso statuto.”

Uno studio dell’SR-TIGET pubblicato in questi giorni su Nature Medicine conferma anche sul lungo periodo un rapporto favorevole tra rischi e benefici, riportando i dati dei 43 pazienti trattati a partire dal 2000.
“In questo lavoro descriviamo come anche dopo la commercializzazione la terapia genica per l’ADA-SCID continui a essere sicura ed efficace – commenta Maddalena Migliavacca, immunologa pediatra e ricercatrice nell’Unità operativa di immunoematologia pediatrica -. come già dimostrato nella fase sperimentale iniziata nel 2000. I pazienti sono tutti vivi e nella maggior parte dei casi non hanno avuto bisogno di ulteriori terapie curative dopo la terapia genica.”
La presa in carico della produzione e distribuzione di Strimvelis è solo il primo passo del percorso di Telethon per salvare terapie geniche “abbandonate” dall’industria.
L’impegno ora è per la la Sindrome di Wiskott-Aldrich
Il secondo è stato annunciato proprio in occasione della Giornata mondiale delle malattie rare: oltre alla terapia per l’ADA-SCID, la Fondazione “si impegna a far sì che la terapia per la Sindrome di Wiskott-Aldrich sia resa disponibile”, previa autorizzazione dell’EMA.
Il disinvestimento dell’industria è arrivato infatti anche per un altro farmaco, stavolta prima della richiesta dell’autorizzazione all’immissione in commercio, e anche in questo caso se ne assumerà la responsabilità Telethon affinché arrivi ai pazienti che ne hanno bisogno.
Di chi dovrebbe essere la responsabilità della produzione dei farmaci orfani?
“Il ruolo del terzo settore è sussidiario e complementare al settore pubblico e a quello industriale, intervenendo quando non ce la fanno -dichiara Benvenuti –. C’è bisogno di migliori condizioni per rendere sostenibili le terapie sviluppate dall’industria, dato che è abbastanza difficile per malattie molto rare fare profitto.
Chiedere poi al pubblico di farsi carico di future terapie significa spostare risorse che il pubblico può impiegare in altri ambiti a impatto maggiore, come nel caso del Covid-19 che ha riguardato milioni di persone, inoltre non è attrezzato.”
La Fondazione auspica comunque che industria e settore pubblico riconoscano questo ruolo al terzo settore, riducendone gli ostacoli: “Ci sono regole europee per applicare ‘sconti’ economici alle piccole e medie imprese nel richiedere l’autorizzazione dall’EMA, ma non alle no-profit che non hanno requisiti di PMI, questo perché non ci si era mai posti il problema essendo noi degli apripista. C’è però stata una grande apertura da parte di EMA, che ci ha concesso alcuni sconti ma che non vengono concessi di norma a livello strutturale. Noi chiediamo sconti solo a livello di tassazione, non su quelle che sono le procedure da seguire e la documentazione da produrre.”
Per Benvenuti inoltre, “Il caso di Telethon può diventare un modello replicabile. Far produrre questo tipo di terapie a enti come Telethon potrebbe costare meno rispetto a farle produrre all’industria: non essendo necessario un ricarico per fare profitto, è possibile garantire prezzi più bassi al Ssn, dando spazio a investitori istituzionali pubblici e privati che possono accontentarsi di ritorni economici più bassi.”
Resta un problema l’accesso alle cure. “Serve recarsi a Milano per ricevere il trattamento. Questo a volte è un limite perché alcuni Stati non concedono il rimborso per questa terapia (e il viaggio da affrontare), perché non riconoscono questo trattamento all’interno dei diritti dei pazienti relativi all’assistenza sanitaria transfrontaliera”, conclude Benvenuti.
Per far fronte anche a questo tipo di problemi, nel 2021 l’Onu ha adottato la Risoluzione “Addressing the Challenges of Persons Living with a Rare Disease and their Families”, puntando tra i suoi obiettivi a garantire un accesso equo e universale a servizi sanitari di qualità.