Tra il mese di aprile e quello di giugno l’European Medicines Agency (EMA) ha approvato l’impiego di due nuovi farmaci per le “terapie avanzate” Advanced Therapy Medicinal Products (ATMP) e autorizzato un’indicazione d’uso aggiuntiva per un paio di quelli già disponibili.
Queste terapie si basano – a differenza dei farmaci tradizionali realizzati con molecole di sintesi chimica – su cellule, DNA e RNA e comprendono i prodotti di terapia genica (editing genomico incluso), di terapia cellulare, d’ingegneria tissutale e di terapie avanzate combinate. Il loro sviluppo è spinto dai progressi delle biotecnologie, da un numero crescente di studi pubblicati e dalle sperimentazioni cliniche, ed è particolarmente promettente per curare gravi malattie rare, croniche e tumori e per trattare gravi ustioni e lesioni.
Aumentano così le cure disponibili per alcune gravi forme di leucemia e il mieloma multiplo, un tumore che colpisce il midollo osseo, e salgono a quindici le terapie avanzate attualmente approvate nell’Unione Europea, undici delle quali hanno ricevuto il consenso anche da parte dell’Agenzia italiana del farmaco (Aifa). Altre valutazioni da parte di EMA sono inoltre previste entro la fine dell’anno.
Le cure innovative si stanno sviluppando in tutto il Mondo
Negli ultimi dieci anni diverse di queste terapie sono state approvate in Europa, come ad esempio la terapia tissutale Holoclar nel 2015 per la riparazione della cornea e quella genica Libmeldy nel 2020 per la cura della leucodistrofia metacromatica (una rara malattia neurodegenerativa), entrambe sviluppate in Italia. Altre patologie interessate sono vari tumori del sangue e alcune malattie della cartilagine.
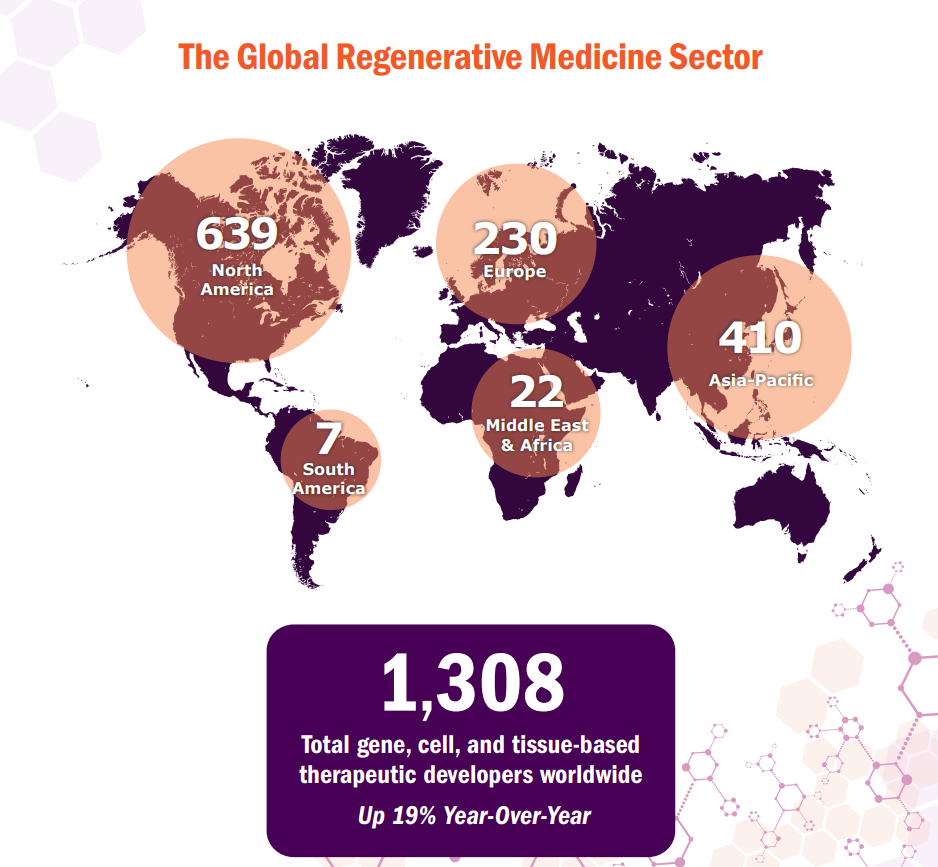
I farmaci per le terapie avanzate sono oggetto di studio in tutti i continenti. Secondo il report annuale dell’Alliance for Regenerative Medicine (ARM), alla fine del 2021 erano più di 1300 nel Mondo gli sviluppatori di nuove tecnologie in questo campo, con un forte incremento rispetto all’anno precedente.
Farmaci a base biologica: l’interferenza di RNA
Fra le tecnologie di frontiera che utilizzano materiale biologico si colloca anche quella che sfrutta la cosiddetta interferenza di RNA (RNA interference, RNAi), un meccanismo alla base di diversi farmaci già approvati, a partire dal 2018, negli Stati Uniti e nell’Unione Europea – compresa l’Italia, dove risale ad aprile l’autorizzazione di Aifa per la rimborsabilità da parte del Sistema sanitario nazionale di Lumasiran, medicinale per la cura dell’iperossaluria primitiva di tipo uno, una grave malattia rara che colpisce soprattutto i reni.
In particolare, ci si serve di brevi filamenti di RNA che interferiscono in maniera mirata con specifiche sequenze di RNA messaggero disattivandole (“silenziamento genico”) o modulandone l’espressione. In questo modo diventa possibile regolare la produzione di determinate molecole da parte delle cellule.
Un esempio è Inclisiran, un importante farmaco approvato da EMA nel 2020 che in persone interessate da episodi cardiovascolari gravi consente di ridurre fino al 50% il livello di colesterolo, limitandone direttamente la sintesi nelle cellule del fegato e abbassando così il rischio di infarto e ictus. Per confermare ulteriormente l’efficacia del farmaco è in corso uno studio internazionale, il Victorion 2P, che coinvolgerà 10mila pazienti nel Mondo e a cui partecipa anche l’Italia, dove la ricerca ha preso il via nel marzo scorso presso il Centro cardiologico Monzino di Milano.
“L’RNA ha un potenziale altissimo dal punto di vista farmacologico – ha affermato Alessandra Ferlini, docente di Genetica medica presso l’Università di Ferrara e direttrice della Genetica medica dell’Azienda ospedaliera, che ha recentemente pubblicato su Science un articolo dedicato ai diversi approcci farmacologici innovativi a base di farmaci a RNA -. Modularlo significa, ad esempio, poter ripristinare la produzione di una specifica proteina, nel caso in cui la sua assenza sia causa di una condizione patologica. Oppure, al contrario, si può agire sull’RNA per ridurre o abolire (‘silenziare’) la sintesi di proteine dannose per l’organismo, come accade in molte malattie genetiche.
Le possibilità di intervento sull’RNA individuate nei laboratori biotech in questi anni sono diverse. Ad esempio, è stato messo a punto l’utilizzo di piccole molecole di RNA, chiamate in biologia oligonucleotidi antisense, capaci di ‘attaccarsi’ all’RNA proprio nel tratto in cui è presente l’errore, ripristinando la sintesi delle proteine mancanti.
I risultati sono molto incoraggianti. È una molecola duttile, anche se fragile, e la sua correzione o manipolazione non induce nelle cellule cambiamenti ‘permanenti’ al di fuori dei risultati terapeutici per i quali viene impiegata.”

Le applicazioni delle terapie a RNA per la cura delle malattie rare sono state entusiasmanti e pionieristiche, secondo la direttrice. “Le malattie rare rappresentano un settore nel quale la ricerca è intensa e di frontiera: da qui spesso scaturiscono ricadute che toccano anche altri ambiti della medicina. Così si sta delineando la cosiddetta medicina genomica, un campo di studi più ampio e trasversale che cambierà completamente la gestione e la cura di moltissime malattie.”

Studi clinici e test inadeguati rallentano l’approvazione. E il costo altissimo è proibitivo per i sistemi sanitari
Gli ATMP possono offrire soluzioni terapeutiche ove quelle disponibili siano poco efficaci o assenti, come avviene per la leucodistrofia metacromatica, nella quale per i casi più gravi (e anche più frequenti) non esisteva una vera cura fino al 2020.
Gli ATMP tuttavia comportano una serie di problemi durante l’iter di sperimentazione e approvazione presso gli enti regolatori. Si tratta infatti di terapie la cui valutazione può risultare complessa per varie ragioni. Ad esempio esistono malattie, come quelle rare, che colpiscono un numero statisticamente molto ristretto di persone e per le quali non esistono medicine, due fattori che impediscono di effettuare gli studi clinici standard richiesti per i farmaci dai protocolli vigenti.
In questi casi, le agenzie di controllo prevedono percorsi accelerati che, pur con la salvaguardia della sicurezza, possono consentire ai pazienti un accesso più veloce alle cure di cui hanno urgente bisogno, come avvenuto per le terapie approvate in Europa negli ultimi anni.
Spesso però gli studi clinici non riescono comunque a fornire dati sufficientemente solidi, soprattutto in relazione al rapporto rischi/benefici, di conseguenza le terapie sperimentate vengono respinte dalle autorità regolatorie.
Fra gli aspetti problematici vi sono inoltre la frequente mancanza di informazioni pre-cliniche attendibili a causa dell’inadeguatezza dei test disponibili e la qualità dei complicati processi di produzione dei farmaci, che può influenzare l’esito delle sperimentazioni. Per questo lo sviluppo di ATMP efficaci e clinicamente disponibili rimane una strada ancora in salita e ricca di ostacoli.
“È un campo in continua e rapida evoluzione – afferma l’Osservatorio terapie avanzate, il portale italiano dedicato all’informazione e alla divulgazione sulle terapie avanzate. La prossima sfida sarà la sostenibilità delle terapie avanzate per i sistemi sanitari, essendo farmaci molto innovativi ma dai prezzi spesso esorbitanti. Negli ultimi anni sono stati diversi i dibattiti sulle terapie avanzate – dal punto di vista dell’applicazione clinica, della bioetica, dei costi e non solo – poiché necessitano di un modello innovativo che in futuro potrebbe richiedere cambiamenti nella gestione standard del processo di ricerca, sperimentazione, autorizzazione e accesso.”

