La campagna vaccinale contro il Covid-19 in Italia ha permesso di evitare circa 8 milioni di casi, oltre 500mila ospedalizzazioni, più di 55mila ricoveri in terapia intensiva e circa 150mila decessi.
Tuttavia come ogni vaccino o farmaco, anche quello contro il Covid-19 può avere effetti collaterali che preoccupano sia chi valuta il proprio rischio personale sia le autorità di sanità pubblica.
L’Agenzia italiana del farmaco (Aifa) ha recentemente pubblicato l’undicesimo Rapporto di farmacovigilanza sui vaccini anti-COVID-19. I dati raccolti e analizzati riguardano le segnalazioni di sospetta reazione avversa registrate nella Rete nazionale di farmacovigilanza tra il 27 dicembre 2020 e il 26 marzo 2022 per i cinque vaccini in uso nella campagna vaccinale in corso.
È sulla base di questi dati che siamo finalmente in grado di formulare un bilancio sui rischi effettivi connessi alle vaccinazioni con i vari preparati utilizzati dal servizio sanitario nazionale italiano. Sono dati importanti perché, a differenza degli studi clinici effettuati dalle case farmaceutiche per testare i vaccini prima dell’eventuale loro utilizzo, sono dati relativi a milioni di casi, raccolti da un’istituzione pubblica in un lungo arco di tempo, ed elaborati secondo un protocollo molto accurato.
Le reazioni avverse ci sono state, ma questi dati consentono a ognuno di farsi un’idea chiara del rapporto rischi/benefici per scegliere con maggior consapevolezza e, sperabilmente, con minor timore nei casi più difficili come quelli delle donne in gravidanza e dei bambini.
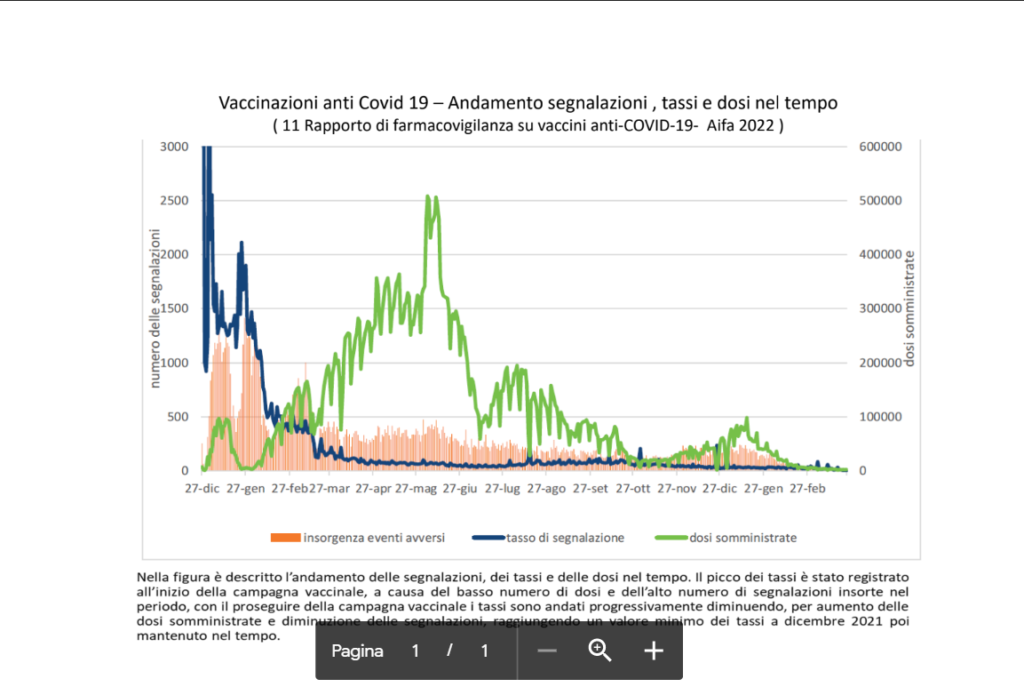
In oltre due anni di campagna vaccinale 99 segnalazioni ogni 100mila dosi
Nell’arco di 15 mesi di vaccinazione in Italia sono pervenute ad Aifa 134.361 segnalazioni di sospetta reazione avversa su un totale di 135.849.988 dosi di vaccino somministrate.
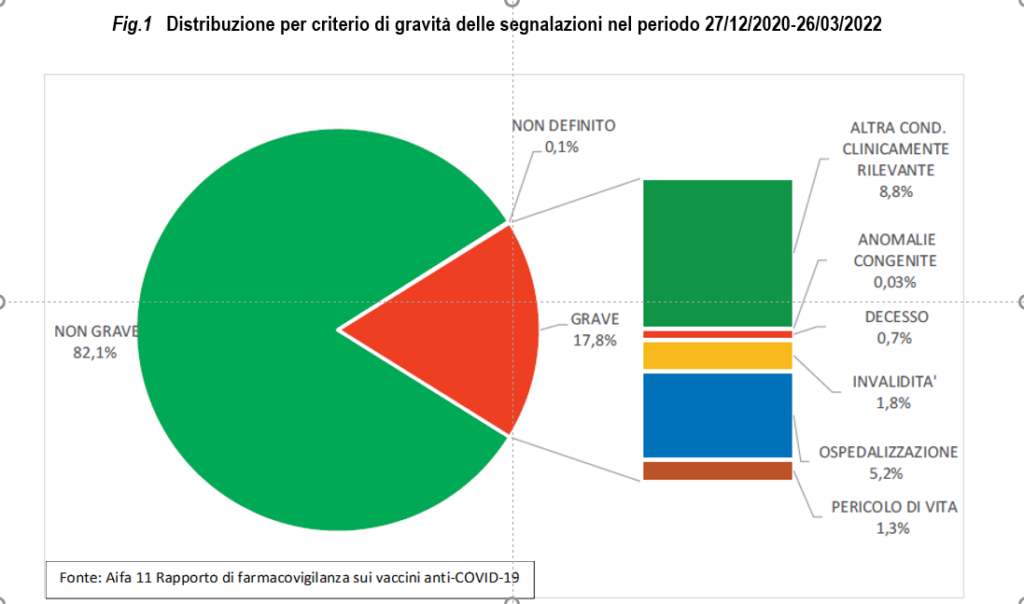
Nell’82,1% dei casi si tratta di eventi non gravi, come dolore in sede di iniezione, febbre, astenia/stanchezza, dolori muscolari.
Col progredire delle somministrazioni le segnalazione di eventi avversi sono andate calando sino a ridursi nel primo trimestre 2022 a 60 ogni 100mila dosi somministrate a fronte di una media complessiva di 99.
Ancor più basso il numero di segnalazioni per il vaccino dei più piccoli di età compresa fra i 5 e gli 11 anni (quasi 5 volte di meno della media totale) e nessuna segnalazione di decesso.
Entro due giorni la maggioranza delle reazioni avverse alla vaccinazione
Indipendentemente dal vaccino, dalla dose e dalla tipologia di evento, la reazione si è verificata nella maggior parte dei casi (72% circa) nella stessa giornata della vaccinazione o il giorno successivo e solo più raramente oltre le 48 ore.
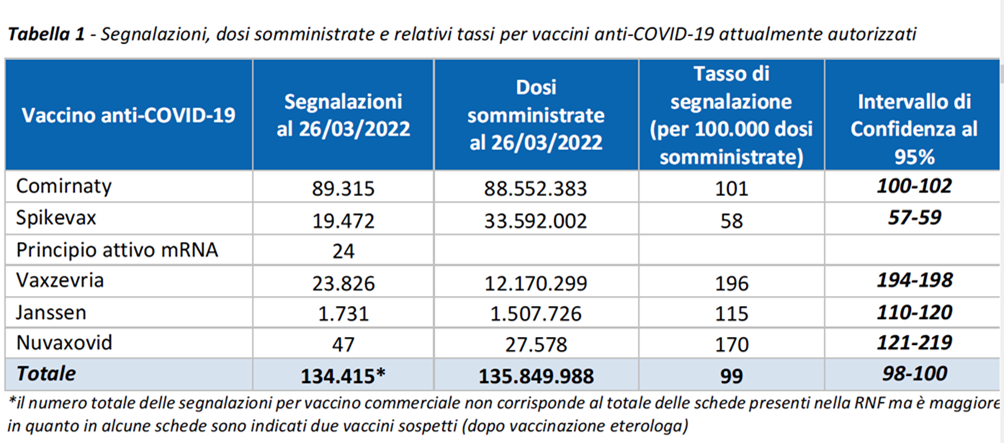
Il vaccino anti Covid-19 mRNA Pfizer/BioNTech Comirnaty è il più utilizzato nella campagna vaccinale italiana (65,2%), seguito dall’anti Covid-19 mRNA-1273 Spikevax, prodotto Moderna (24,7%), il vaccino anti Covid-19 a vettore adenovirale Vaxzevria (9,0%) noto come AstraZeneca, il vaccino Janssen (del gruppo Johnson & Johnson)a vettore adenovirale umano (1,1%) infine, Nuvaxovid Vaccino anti Covid-19 a vettore virale ricombinante, adiuvato (0,02%), in uso dal 28 febbraio 2022.
Di seguito la distribuzione delle segnalazioni di sospetti eventi avversi per tipologia di vaccino : 101 segnalazioni per 100mila dosi somministrate di Comirnaty Pfizer/BioNTech, 58 per 100mila dosi di SpiKewax/Moderna, 196 per 100mila dosi di Vaxzevria/ AstraZeneca, 115 per 100mila dosi di Janssen, 170 per 100mila dosi di Nuvaxovid. Pfizer/BioNTech Comirnaty rappresenta il 65% delle dosi di vaccino somministrate.

La sicurezza viene verificata su tutti i casi sospetti con una metodica molto complessa
Il sistema di farmacovigilanza dei vaccini raccoglie e valuta le segnalazioni di eventi avversi dopo la somministrazione di un vaccino (Adverse Event Following Immunization) inviate da medici, operatori sanitari e persone vaccinate.
Indagare ogni evento sospetto che compare dopo una vaccinazione serve a raccogliere quante più informazioni possibili per accertare se esiste un nesso causale con la vaccinazione.
Ciò consente alle autorità regolatorie come Aifa di verificare la sicurezza dei vaccini nella pratica, confermando quanto è stato osservato negli studi precedenti all’autorizzazione ed eventualmente identificando nuove potenziali reazioni avverse, soprattutto se rare (1 su 10.000 dosi somministrate) e molto rare (meno di 1 su 10.000 dosi somministrate).
Un ampio numero di segnalazioni, ricorda Aifa, non implica una maggiore pericolosità del vaccino, ma è indice dell’elevata capacità del sistema di farmacovigilanza nel monitorarne la sicurezza.
L’analisi delle segnalazioni di eventi avversi permette di classificarli come:
- Evento avverso che è qualsiasi episodio sfavorevole che si verifica dopo la somministrazione di un vaccino, ma che non è necessariamente causato dalla vaccinazione.
- Reazione avversa, invece, è una risposta nociva e non intenzionale a una vaccinazione per la quale è possibile stabilire una relazione causale con la vaccinazione stessa.
Per distinguere l’evento avverso dalla reazione avversa è necessario valutare se è possibile risalire a una causa legata al vaccino. Va ricordato che la relazione temporale tra la vaccinazione e la comparsa di un evento avverso non è una condizione sufficiente per decretarne la causalità.
Per classificare gli eventi avversi e stabilire l’esistenza di una relazione causale col vaccino, il Comitato consultivo globale per la sicurezza dei vaccini (Global Advisory Committee on Vaccine Safety, GACVS) dell’Organizzazione mondiale della sanità (Oms), ha messo a punto un algoritmo specifico che tiene conto di diversi fattori:
- relazione temporale fra la vaccinazione e l’evento segnalato;
- presenza di possibili spiegazioni alternative;
- prove a favore dell’associazione tra la vaccinazione e l’evento;
- precedenti evidenze di letteratura;
- frequenza dell’evento segnalato nella popolazione generale, anche non vaccinata;
- plausibilità biologica.
Gli eventi avversi vengono di conseguenza classificati come:
- correlabile se l’associazione causale fra evento e vaccino è considerata plausibile;
- non correlabile se altri fattori possono giustificare l’evento;
- indeterminato se l’associazione temporale è compatibile, ma non vi sono prove sufficienti a supportare un nesso di causalità.
Non classificabili si definiscono le eventuali segnalazioni prive di informazioni sufficienti.
Rari o molto rari miocardite, pericardite e shock anafilattico
Fra gli eventi avversi gravi per cui si è stabilita una relazione col vaccino quelli più comunemente segnalati sono febbre alta, cefalea e dolori muscolari e articolari diffusi (rispettivamente 1,3 – 1 – 0,8 casi ogni 100.000 dosi somministrate), seguiti da astenia e parestesie (0,5 casi ogni 100.000 dosi).
Vi sono poi eventi avversi di frequenza da rara a molto rara: miocardite con circa 2 casi segnalati ogni milione di dosi somministrate (1 caso dopo la 3a dose); pericardite con circa 4 casi ogni 1 milione di dosi somministrate (1,2 casi dopo 3a dose), in assenza di decessi per entrambe. Inoltre paralisi periferica del nervo facciale con 4 casi ogni milione di dosi somministrate ( prevalentemente dopo la 1a dose) e shock anafilattico con 3 casi per milione di dosi somministrate.
Sono 0,2 casi ogni milione di dosi somministrate gli eventi gravi con esito mortale
Per la totalità dei vaccini, otto casi su dieci segnalati (82,1%) non sono gravi. Le sospette reazioni gravi corrispondono al 17,8% del totale degli eventi avversi segnalati, pari a 18 eventi gravi ogni 100.000 dosi somministrate.
In base a criteri standardizzati, l’evento avverso viene definito grave se determina condizioni clinicamente rilevanti compresa la febbre elevata (superiore a 38,5 gradi centigradi), se causa ricorso al pronto soccorso, ospedalizzazione, pericolo immediato di vita, invalidità, anomalie congenite, decesso.
Nella figura 1 è riportata la distribuzione delle segnalazioni di eventi avversi per gravità, con il dettaglio del criterio di gravità per tutti i vaccini.
La maggior parte delle segnalazioni gravi non hanno richiesto un intervento in ambiente ospedaliero.
Secondo il Rapporto Aifa di 20.842 segnalazioni di sospetti eventi avversi gravi per cui è stato possibile valutare un nesso di causalità secondo i criteri indicati dall’Oms: 7.025 (33,7%) sono risultate correlabili alla vaccinazione, 4.604( 22,1%) non correlabili mentre per circa il 40% le prove reperite non sono state sufficienti per stabilire un nesso di causalità.
Delle segnalazioni di eventi gravi con esito mortale sono risultati correlabili alla vaccinazione 27 casi (3,6%) sui 748 valutati, con un tasso di circa 0,2 casi ogni milione di dosi somministrate.

Basarsi sui dati AIFA non credo che sia una scelta ragionata. Prima bisognerebbe dare una risposta sensata al eno alle seguenti domande: perché tra i possibili morti non sono nemmeno presenti quelli in cui le perizie in tribunale hanno già individuato il nesso di causalità come il caso emblematico della diciottenne Camilla a Genova. Come mai poi le reazioni segnalate in altre nazioni sono molto più numerose?
Sui vaccini in uso nella campagna vaccinale contro l’agente di Covid19 le informazioni raccolte dalla Rete nazionale di farmacovigilanza ed elaborate da Aifa, secondo protocolli scientifici condivisi con le principali agenzie sanitarie internazionali, rappresentano la migliore fonte di dati attualmente disponibile nel Paese.
Come risulta dagli 11 Rapporti sinora prodotti da Aifa il sistema di Sorveglianza non trascura nessun tipo di segnalazione tantomeno i casi di trombosi associata a trombocitopenia (VITT) come quello a cui viene fatto riferimento, fermo restando che i dati vengono restituiti in forma anonima. In particolare per i vaccini a vettore virale Vaxzevria (AstraZeneca) e Janssen (Johnson & Johnson) è previsto un questionario per la Sindrome trombotica associata a trombocitopenia (inclusa la trombosi con sindrome trombocitopenica TTS)
E’ stato proprio a seguito del ricevimento delle segnalazioni del Comitato per la Valutazione del Rischio per la Farmacovigilanza (PRAC) dell’European Medicines Agency (EMA) che il Ministero della Salute ha emesso una prima raccomandazione a un uso preferenziale di Vaxzevria nelle persone di età superiore ai 60 anni, in data 07/04/2021, e di COVID-19 Vaccine Janssen, in data 21/04/2021. Inoltre è stato istituito presso AIFA un Gruppo di Lavoro Emostasi e Trombosi, con il contributo di alcuni fra i massimi esperti nazionali di trombosi ed emostasi.
Il tema viene trattato con maggior dettaglio nel Rapporto annuale sulla sicurezza dei vaccini anti-COVID-19 27/12/2020 – 26/12/2021 a pag. 71, dove si affronta anche il tema delle differenze fra i diversi Paesi .
Nella risposta viene trascurato l’esempio specifico della morte della giovane Camilla a Genova che non è fra le morti indicate come correlate da AIFA. L’aiuto un po’ suggerendole di controllare le date fra la vaccinazione e l’evento morte in quel preciso esempio. Ma proprio questo mette in luce come con queste metodologie non si raggiunga, per me, una situazione di attendibilità. È lo stesso metodo, che esclude la sorveglianza attiva, a dover essere messo in discussione.
Immagino che si riferisca a Camilla Canepa, la studentessa di 18 anni di Sestri Levante morta , secondo notizie di stampa, per una trombosi nel giugno 2021 all’ospedale San Martino di Genova dopo essere stata vaccinata con vaccino anti Covid19 AstraZeneca.
In realtà non ci sono elementi che ci consentono di affermare che il caso non sia stato valutato da Aifa dal momento che il report fornisce dati anonimi. In ogni caso sembra poco probabile che un caso assurto agli onori della cronaca non sia giunto alla valutazione della rete nazionale di farmacovigilanza che riceve segnalazioni non solo dai sanitari ma anche dai semplici cittadini/pazienti, avvocati o forze armate. In ogni caso nel Rapporto annuale sulla sicurezza dei vaccini anti-COVID-19 https://www.aifa.gov.it/documents/20142/1315190/Rapporto_annuale_su_sicurezza_vaccini%20anti-COVID-19.pdf aggiornato al 26 dicembre 2021 a pagina 71 – 78 troviamo un approfondimento dedicato ad “Eventi trombotici e tromboembolici associati a piastrinopenia “ su dati estratti dalla Rete Nazionale di Farmacovigilanza comprendente tutte le segnalazioni inserite dall’inizio della campagna vaccinale relative alla riduzione del numero di piastrine, eventi trombotici e tromboembolici. L’esame delle segnalazioni è stato poi affidato alla valutazione indipendente di tre esperti in vaccinovigilanza che le ha classificate secondo la definizione della Brighton Collaboration una comunità scientifica che si occupa della sicurezza dei vaccini . L’esito di questa valutazione ha stabilito una correlazione con la vaccinazione con adenovirus di 104 casi di trombocitopenia e trombosi immunitaria indotta da vaccino (VITT). Di questi 10 casi hanno avuto esito mortale (6 femmine e 4 maschi) e sono risultati correlabili alla vaccinazione (9 dopo Vaxzevria Astrazeneca e 1 dopo COVID-19 Vaccine Janssen). L’età media dei casi fatali è 45,3 anni (mediana 45) ed 1 caso ha meno di 20 anni ( potrebbe trattarsi del caso in questione).
I casi di morte correlabili alla vaccinazione, per tutte le cause, sono 114 pari allo 0,94 per 100.000 dosi somministrate di Vaxzevria Astrazeneca e 28 pari all’ 1,87% di Vaccine Janssen (Janssen Cilag) a fronte di un valore di 0,66 per 100.000 dosi somministrate per Comirnaty ( Pfizer/BioNTech) e 0,61 Spikevax (Moderna).
Come ricorderà la somministrazione dei vaccini Vaxzevria- AstraZeneca e Vaccine Janssen- è stata dapprima sospesa per le persone di età inferiore a 60 anni e successivamente per tutti .
Nei rapporti Aifa successivi ( marzo 2022 e giugno 2022) non sono stati segnalati altri casi di trombosi associata a trombocitopenia (VITT), a fronte di un numero limitato di dosi somministrate, per cui i tassi di segnalazione di tali eventi restano sostanzialmente invariati.
Gli esperti concludono che i casi di morte osservati in soggetti sani sono per lo più ascrivibili a eventi avversi gravi molto rari, come la trombocitopenia e trombosi immuno-mediata e le reazioni anafilattiche indotte da vaccino.